المحتوى
في عام 1869 نشر ديمتري منديليف ورقة بعنوان "حول علاقة خواص العناصر بأوزانها الذرية". في تلك الورقة أنتج ترتيبًا مرتبًا للعناصر ، وسردها بترتيب زيادة الوزن وترتيبها في مجموعات بناءً على خواص كيميائية مماثلة. على الرغم من بقاء عقود عديدة قبل اكتشاف تفاصيل التركيب الذري ، فإن جدول منديليف قد نظم بالفعل عناصر من حيث تكافؤهم.
العناصر والوزن الذري
في Mendeleevs ذرات الوقت كان يعتقد أن غير قابلة للتجزئة ، والكيانات الفريدة. كان البعض أثقل من الآخرين ، وكان من المنطقي ترتيب العناصر عن طريق زيادة الوزن. هناك نوعان من المشاكل مع هذا النهج. أولاً ، إن قياس الوزن مهمة صعبة ، ولم تكن العديد من الأوزان المقبولة ليوم مندليف صحيحة. ثانياً ، اتضح أن الوزن الذري ليس في الحقيقة المعلمة ذات الصلة. الجداول الدورية اليوم تضع العناصر حسب عددها الذري ، وهو عدد البروتونات في النواة. في وقت منديليفس ، لم يتم اكتشاف البروتونات بعد.
العناصر والخواص الكيميائية
كتب منديليف أن "الترتيب وفقًا للوزن الذري يتوافق مع تكافؤ العنصر وإلى حد ما الفرق في السلوك الكيميائي." كان التكافؤ ، حسب فهم مندليف ، مؤشراً على قدرة عنصر ما على الاندماج مع عناصر أخرى. قام مندليف بجمع ترتيب الوزن الذري مع التكافؤ المشترك لتنظيم العناصر في الجدول. أي أنه قام بتنظيم العناصر في مجموعات وفقًا لخصائصها الكيميائية. نظرًا لتكرار هذه الخصائص في كثير من الأحيان ، كانت النتيجة عبارة عن جدول دوري يحتوي فيه كل عمود عمودي ، يسمى مجموعة ، على عناصر لها خصائص متشابهة ، ويقوم كل صف أفقي ، يسمى فترة ، بترتيب العناصر حسب الوزن ، ويزداد من اليسار إلى اليمين وأعلى إلى أسفل.
التركيب الذري
بعد حوالي 50 عامًا من الجدول الدوري الأول لمندليف ، اكتشف العلماء أن الذرة بنيت حول نواة ذات بروتونات موجبة الشحنة و نيوترونات محايدة - وكلاهما ثقيل نسبيًا. يحيط بالنواة ذات الشحنة الموجبة سحابة من الإلكترونات سالبة الشحنة. يتطابق عدد البروتونات - التي يطلق عليها أيضًا الرقم الذري - عادةً مع عدد الإلكترونات. اتضح أن عدد الإلكترونات التي يحددها العنصر يحدد خواصه الكيميائية إلى حد كبير. لذلك يتم تحديد الترتيب الصحيح في الجدول الدوري بعدد الإلكترونات ، وليس الوزن كما اقترح منديليف في الأصل.
إلكترونات التكافؤ
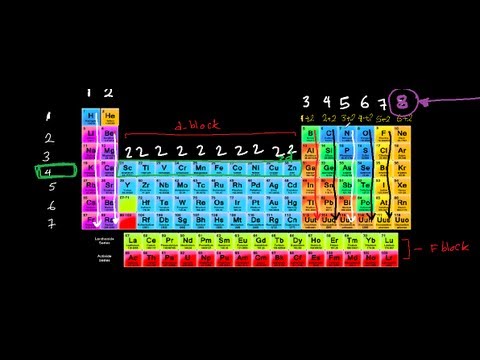
يتم ترتيب الإلكترونات الموجودة في السحابة المحيطة بنواة العناصر في طبقات تسمى القذائف. كل قذيفة لديها عدد معين من الإلكترونات التي يمكن أن تعقد. عندما تمتلئ كل قذيفة يتم إضافة قذيفة جديدة حتى يتم حساب جميع الإلكترونات. تسمى الإلكترونات الموجودة في القشرة الخارجية إلكترونات التكافؤ ، لأن تفاعلاتها هي التي تحدد الخواص الكيميائية لعنصر ما. تبين أن الأعمدة التي تم إعدادها لتجميع العناصر بخصائص كيميائية مماثلة هي نفس الأعمدة المحددة بواسطة عدد إلكترونات التكافؤ. تحتوي العناصر الموجودة في المجموعة 1A على إلكترون واحد للتكافؤ ، وتضيف كل مجموعة أعمدة إلى اليمين إلكترونًا واحدًا آخر. تصبح المنظمة غامضة بعض الشيء مع عناصر المجموعة ب ، ولكن يتم تجميع كل منها أيضًا بعدد إلكترونات التكافؤ الخاصة بها.