المحتوى
يعتمد العلماء على المعايرة المباشرة للعثور على كمية المادة داخل محلول مع التفاعلات الكيميائية. عند إجراء هذه العملية بطريقة صحيحة ، يمكن أن تصور بدقة الكميات الكيميائية باستخدام الأحماض المتخصصة والأواني الزجاجية المختبرية. لكي يعمل المعايرة بشكل صحيح ، يجب أن يتشكل المجمع الأخير بسرعة كافية حتى يتمكن العلماء من تحليله.
تعريف
المعايرة المباشرة هي وسيلة لتحديد محتويات المادة كمياً. قد يكون العلماء على بينة من المادة المتفاعلة ، لكنهم لا يعرفون كمية المادة المتفاعلة. يعتمد المعايرة المباشرة في بعض الأحيان على مؤشرات تستجيب للمواد التي تم تحليلها ، والتي تسمى الحليلة. في أوقات أخرى ، تعتمد الأساليب على استخدام أيونات المعادن المضافة ، والتي هي ذرات أو جزيئات فردية من نوع معين من المعدن.
حمض الإيثيلين دي أمينيتراكتيك وطريقة الجهد
يمكن للفنيين إجراء المعايرة باستخدام حمض الإيثيلين دي أمينيتريتيك مع مؤشرات أيون المعادن. لا تعمل هذه الطريقة في جميع المواقف ، حيث يكون رد الفعل بطيئًا في بعض الأحيان لدرجة أن المعايرة تصبح غير واقعية. يجب أن يحتوي أيون المعادن المستخدم على ثبات أقل من الحليلة. طريقة أخرى للمعايرة المباشرة هي طريقة قياس الجهد ، وتستخدم للكشف عن نقطة النهاية مع أيونات المعادن التي لديها أقطاب كهربائية محددة المتاحة. نقطة النهاية هي النقطة التي تنتهي فيها عملية المعايرة.
المعايرة المعقدة
بالنسبة للمعايرة المعقدة ، يستخدم العلماء الأحماض الأمينية الكربوكسيلية لتحديد المعادن. تتشكل المجمعات الملونة ويستخدم العلماء البيانات التي تم جمعها من هذا التكوين لتحديد كمية الحليلة. تشتمل الطريقة المباشرة لضبط المعايرة المعقدة على استخدام محلول ملح معدني معقم بمحلول مركب معقد. تحتوي حلول المركبات المركبة على ذرات أو مركبات تشكل مركبات ذات ذرات أو مركبات أخرى. يجد العلماء نقطة التكافؤ من مؤشر إضافي. نقطة التكافؤ هي عندما يكون المعاير الإضافي مساويًا بطريقة متكافئة في التحليل. يتضمن قياس العناصر المتفاعلة موازنة التفاعلات الكيميائية.
الحل السحري
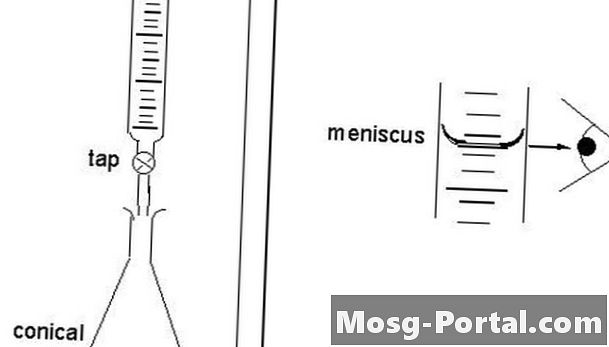
يسمى المعايرة المباشرة "مباشر" لأن العالم يقترب من نقطة النهاية مباشرة. يدخل المقياس الحل من خلال القطرات من السحاحة بحيث لا يتجاوز الانخفاض النهائي نقطة النهاية. من خلال المعايرة المباشرة ، يتعامل العلماء مع مادة قابلة للذوبان في محلول ، وهي موجودة في وعاء يسمى الميترات. الحل الموحد يسمى المقياس. يتم تحديد نقطة النهاية آليا أو بصريا بمساعدة مؤشر. يضيف العلماء المقياس إلى السحاحة الصحيحة ، وهي قطعة رأسية واسطوانية من الأواني الزجاجية بنقرة دقيقة تطلق كميات صغيرة من السائل بكميات محددة. يملأ العلماء السحاحة بسعة 30 إلى 100 بالمائة.