
المحتوى
وببساطة حساباتهم ، أنشأ الكيميائيون وحدة قياسية لعدد ذرات مركب معين مشارك في تفاعل أو عملية كيميائية أخرى. يحددون مولًا واحدًا (مول) على أنه كمية أي مادة لها نفس عدد الوحدات الأساسية مثل 12 جرامًا من الكربون -12 ، وهو رقم أفوجادروس (6.022 × 10)23). يعرّف نظام القياس SI (المتري) المليمتر (Mmol) بأنه الألف من المول. تقوم عمومًا بحساب عدد مولات المادة عن طريق وزن الكمية الموجودة لديك. إذا كنت ترغب في التحويل إلى Mmol ، اضرب في 103 (1,000).
TL ؛ DR (طويل جدًا ؛ لم يقرأ)
واحد الخلد يساوي عدد Avogadros من جزيئات مركب معين. المليمول (Mmol) هو الألف من المول.
كيفية حساب الشامات
تقاس الكتل الذرية بوحدات الكتلة الذرية (AMU). واحد AMU هو بالضبط 1/12 كتلة نواة ذرة الكربون - 12 في حالتها الأرضية. يتم تعريف واحد من الخلد من المواد ليكون مساويا لعدد Avogadros من جزيئات هذه المادة. وفقًا لهذا التعريف ، يكون وزن جزيء واحد من مادة ما بالجرام هو نفس عدد وزن جسيم فردي لتلك المادة في AMU. على سبيل المثال ، يكون الوزن الذري لـ carbon-12 هو 12 AMU ، لذلك يزن جزيء واحد من الكربون -12 12 جرام.
النظر في حاوية مليئة غاز الهيدروجين (H2). كل جسيم في الحاوية عبارة عن جزيء يتكون من ذرتين هيدروجين ، لذا فأنت تحتاج فقط إلى معرفة الكتلة الذرية للهيدروجين لحساب الوزن الجزيئي. تسرد معظم إصدارات الجدول الدوري الكتلة الذرية لكل عنصر تحت الرمز الخاص به. بالنسبة للهيدروجين ، الذي يحتوي على بروتون واحد في نواته ، فإنه يحتوي على 1.008 AMU ، وهو متوسط لجميع نظائر الهيدروجين التي تحدث بشكل طبيعي. وبالتالي ، فإن الكتلة الذرية لغاز الهيدروجين هي 2.016 AMU ، ويزن الخلد الواحد من غاز الهيدروجين 2.016 جرام. للعثور على عدد الشامات في عينتك ، يمكنك وزن العينة بالجرام وتقسيم ذلك الوزن على الوزن الجزيئي لغاز الهيدروجين بالجرام. على سبيل المثال ، تحتوي عينة تزن 15 جرامًا من غاز الهيدروجين النقي على 7.44 مول.
تحويل إلى Mmol
في بعض الأحيان تكون الكميات قيد التحقيق صغيرة للغاية بحيث يكون التعبير عنها في الشامات مرهقًا. أدخل المليمول. بضرب عدد المولات في الألف ، يمكنك تحويل عدد صغير جدًا إلى رقم أكثر قابلية للإدارة. هذا مناسب بشكل خاص عند التعامل مع وحدات الصوت بترتيب الملليتر.
1 مول = 1000 مل
تركيز المحلول
يستخدم الكيميائيون المولية كمقياس لتركيز مركب معين في المحلول. يعرّفون المولية كعدد الشامات لكل لتر. يمكنك تحويل المولية إلى الملليمتر عن طريق ضرب 1000. على سبيل المثال ، يحتوي محلول 1 مول (المولي ، والمكتوب أيضًا باسم M) على تركيز 1 مول لكل لتر. هذا يعادل 1،000 Mmol (millimolar ، كما هو مكتوب في بعض الأحيان حل mM) ، وهو واحد يحتوي على 1000 Mmol لكل لتر.
مثال
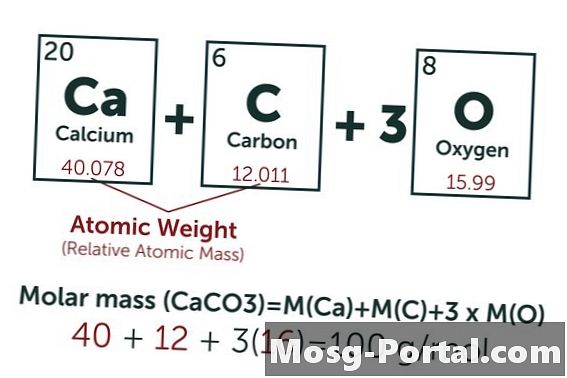
يحتوي المحلول على 0.15 جرام من كربونات الكالسيوم. كم ميليمول هذا؟
الصيغة الكيميائية لكربونات الكالسيوم هي CaCO3. يبلغ الوزن الذري للكربون (C) حوالي 12 AMU ، ووزن الأكسجين (O) حوالي 16 AMU ووزن الكالسيوم (Ca) حوالي 40 AMU. يزن كل جزيء من كربونات الكالسيوم 100 AMU ، مما يعني أن الخلد الواحد يزن حوالي 100 جرام. يمثل الوزن البالغ 0.15 جرام 0.15 جم ÷ 100 جم / مول = 0.0015 مول. هذا يعادل 1.5 مل
ما هو المولية والميليمرية لكربونات الكالسيوم هذه في 2.5 لتر من المحلول؟
يتم تعريف Molarity على أنه عدد المولات لكل لتر ، لذلك قسّم عدد المولات على 2.5 للحصول على المولية: 0.0015 ÷ 2.5 =
0.0006 م
اضرب ب 1000 للحصول على المليموليتية =
0.6 مم
لاحظ أنك تصل إلى نفس النتيجة للحصول على المليموليت إذا قمت بتقسيم عدد المليمول على حجم الحل.