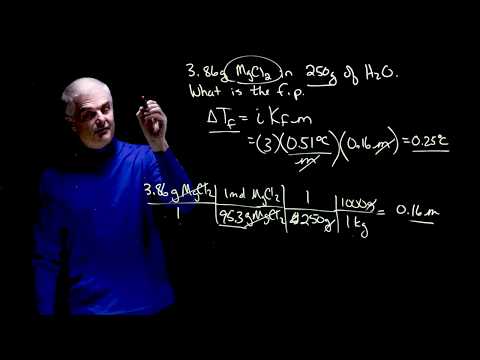
المحتوى
إذا افترضنا وجود ضغط قياسي في جو واحد ، فإن نقطة التجمد هي درجة الحرارة التي يتكثف فيها السائل إلى مادة صلبة. يمكن أن تصبح بعض الغازات ، مثل ثاني أكسيد الكربون ، مواد صلبة دون المرور عبر الطور السائل عبر عملية تسمى التسامي. تحتوي جميع السوائل والغازات ، باستثناء الهليوم ، على نقاط تجمد مميزة اكتشفها العلماء من خلال التجربة ، وليس من خلال الحساب. ومع ذلك ، فإن الصيغة العامة المعروفة باسم Blagdens Law تسمح لك بحساب الكيفية التي ستؤدي بها إضافة مادة مذابة إلى خفض درجة تجمد المذيب بالتناسب المباشر مع تركيز المحلول.
بحث عن كتلة واحدة من الخلد المذاب. الخلد هو عدد محدد من الجزيئات - أيونات أو ذرات أو جزيئات - في مادة ما. هذا الرقم المحدد هو Avogadros ثابت ، 6.02 × 10 ^ 23. يمكنك البحث عن كتلة الخلد المذاب على الإنترنت أو في كتاب الكيمياء. على سبيل المثال ، كتلة واحدة من كلوريد الصوديوم أو ملح الطعام ، هي 58.44 جرام / مول.
بحث في خصائص المذيب. على سبيل المثال ، يمكنك البحث عن H20 ، أو الماء ، على مواقع الويب المختلفة وتجد أن نقطة التجمد تبلغ صفر درجة مئوية. الماء له خاصية أخرى ، تسمى محتواها بالتبريد ("Kf") تساوي 1.86 في وحدات (درجات مئوية × كيلوغرام / مول). يصف Kf للمذيب مقدار سقوط نقطة التجمد عند إضافة المذاب.
تحديد مولات ("م") من الحل ، الذي يعرف بأنه عدد مولات المذاب في كل كيلوغرام من المذيب. على سبيل المثال ، إذا قمت بإضافة 58.44 غراماً من كلوريد الصوديوم إلى كيلوغرام واحد من الماء - وهو أيضًا لتر واحد من الماء - لديك محلول بالماء المالح مع مولات من مول واحد من الملح / كيلوغرام واحد من الماء ، أو مول واحد / كيلوغرام.
البحث عن عامل هوف فانت ("أنا") عن المذاب. هذه هي نسبة مولات الذوبان قبل وبعد الذوبان. على سبيل المثال ، ينفصل جزيء واحد من كلوريد الصوديوم في الماء ليشكل الخلد لكل من أيونات الصوديوم والكلور. لذلك ، ملح الطعام له عامل هانت فانت من اثنين.
احسب انخفاض نقطة التجمد باستخدام الصيغة Tf = (i x Kf x m) ، حيث Tf هي مقدار درجة نقطة التجمد التي تنخفض بالدرجات مئوية. في مثالنا ، Tf = (2 × 1.86 × 1) ، أو 3.72 درجة مئوية ، تسقط نقطة تجمد الماء من الصفر إلى 3.72 درجة مئوية.