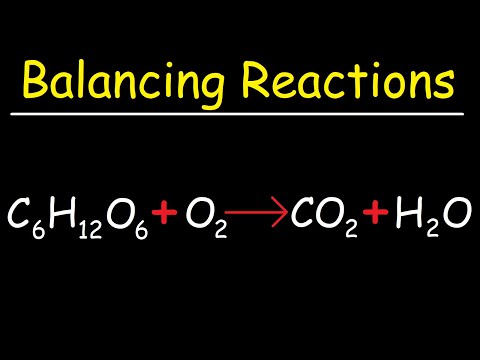
المحتوى
وفقًا لـ Nivaldo Tros "Chemistry" ، عند حدوث تفاعل كيميائي ، يتم وصفه عادةً بواسطة شيء يسمى المعادلة الكيميائية. تكون المواد المتفاعلة على الجانب الأيسر ، والمنتجات الموجودة على الجانب الأيمن ، مع وجود سهم في المنتصف للدلالة على التغيير. يكمن التحدي في قراءة هذه المعادلات عندما يكون جانب المنتج يحتوي على عناصر أكثر من الجانب المتفاعل. في هذه الحالة ، ستحتاج إلى موازنة المعادلة. يتكون أكسيد المغنيسيوم المشهور في الحفاظ على النباتات والكتب من مزيج من المغنيسيوم والأكسجين. السؤال هو ، كم من كل؟
المغنيسيوم زائد الأكسجين يعطي أكسيد المغنيسيوم
خذ الجدول الدوري ، ابحث عن الرموز للعناصر المعينة واكتبها. لاحظ أن مادة المغنيسيوم وغاز الأكسجين هي المواد المتفاعلة ، في حين أن أكسيد المغنيسيوم هو المنتج. بما أن الأكسجين غاز ، فهو جزيء ثنائي الذرة ، وهذا يعني أنه يأتي في زوج.
Mg + O2 ----> MgO
التعرف على التغييرات التي يلزم إجراؤها. على الجانب الأيسر ، يوجد جزيئان من الأكسجين ، بينما يوجد على اليمين واحد فقط.
نظرًا لأنه لا يمكننا ببساطة طرح جزيء من الأكسجين من الجانب الأيسر للمعادلة ، ولا يمكننا تغيير معادلة أكسيد المغنيسيوم المنتج ، يجب أن نلاحظ موضع المغنيسيوم على الجدول الدوري ، ونتذكر معرفتك السابقة بالارتباط الأيوني.
عند تفاعل ذرتين من هذا العنصر مع جزيء واحد من غاز الأكسجين ، سيتم إعطاء أحد إلكتروناته إلى قشرة التكافؤ بالأكسجين ، مما يضطر المنتج النهائي إلى امتلاك ذرة واحدة فقط من الأكسجين ، والتي نرى أنها تفعل ذلك.
بأخذ قلمك على الورق ، فإن ما عليك فعله هو إضافة "2" أمام المغنيسيوم على الجانب الأيسر ، مما يجعل الإجابة النهائية: 2 Mg + O2 ---> 2 MgO